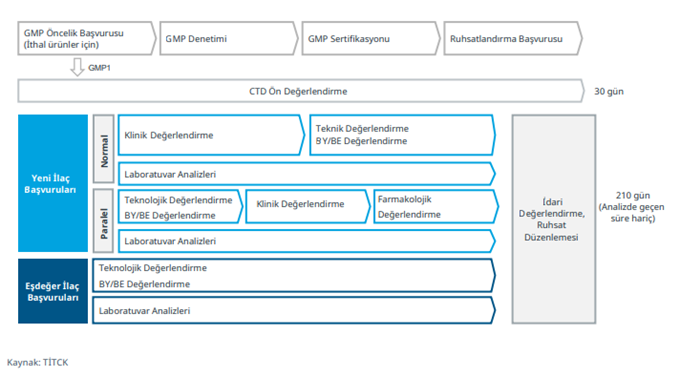
Türkiye’de ilaç ruhsatlandırma süreçleri Türkiye İlaç ve Tıbbi Cihaz Kurumu (TİTCK) tarafından yürütülmekte olup ön değerlendirme, bilimsel değerlendirme ve idari değerlendirme basamaklarından oluşur. Referans ve eşdeğer ilaçların ruhsatlandırma süreçlerinde takip edilen aşamalar Şekil 1’de verilmiştir. Ruhsatlandırılacak ürünlerin üretim yerleri için TİTCK tarafından İyi Üretim Uygulamalarına (GMP) uygun üretim yapıldığına dair sertifika düzenlenmesi gerekmektedir. İlgili kılavuz doğrultusunda başvuru yapılarak öncelik alan ürünlerin denetim süreçleri ile ruhsatlandırma süreçleri paralel olarak başlatılabilir. Ruhsat süreçleri TİTCK tarafından GMP sertifikası düzenlenmeden tamamlanamaz.
Türkiye’de ilaç ruhsatlandırma süreçleri Türkiye İlaç ve Tıbbi Cihaz Kurumu (TİTCK) tarafından yürütülmekte olup ön değerlendirme, bilimsel değerlendirme ve idari değerlendirme basamaklarından oluşur. Referans ve eşdeğer ilaçların ruhsatlandırma süreçlerinde takip edilen aşamalar Şekil 1’de verilmiştir. Ruhsatlandırılacak ürünlerin üretim yerleri için TİTCK tarafından İyi Üretim Uygulamalarına (GMP) uygun üretim yapıldığına dair sertifika düzenlenmesi gerekmektedir. İlgili kılavuz doğrultusunda başvuru yapılarak öncelik alan ürünlerin denetim süreçleri ile ruhsatlandırma süreçleri paralel olarak başlatılabilir. Ruhsat süreçleri TİTCK tarafından GMP sertifikası düzenlenmeden tamamlanamaz.
Ruhsat başvuru tarihinden itibaren 30 gün içinde kurum tarafından ön değerlendirme yapılır. Ön değerlendirme sürecinin tamamlanmasının ardından sonuç başvuru sahibine bildirilir. Eksik bulunan dokümanlar başvuru sahibi tarafından 30 gün içerisinde tamamlanmalıdır. Tamamlanan dokümanlar kurum tarafından 30 gün içerisinde değerlendirilir. Eksik bulunan başvurular iade edilir. Uygun bulunan başvuruların ruhsatlandırma süreci TİTCK ruhsatlandırma kapasitesi göz önünde bulundurularak Şubat, Mayıs, Ağustos ve Kasım aylarında başlatılabilir. İlgili dönemlerde ruhsatlandırma süreci başlatılacak ürünler, Takvimlendirme Süreçlerine İlişkin Kılavuz doğrultusunda belirlenir.
Referans ilaçlarda ruhsat süreci klinik değerlendirmenin ardından teknik değerlendirme, biyoyararlanım (BY) / biyoeşdeğerlik (BE) değerlendirme ve farmakolojik değerlendirme ile devam eder. Referans ilaçların yurt dışında bir otoritede ruhsatlandırma süreçleri başlatılmış ise TİTCK’ya da paralel olarak başvuruları gerçekleştirilebilir. Ancak ruhsatlandırma sürecinin tamamlanabilmesi için yurt dışı onay sürecinin tamamlanmış olması gerekmektedir.
Eşdeğer ilaç başvurularında, referans ilaç başvurularından farklı olarak klinik ve farmakolojik değerlendirme yapılmaz. Teknik değerlendirme ve BY/ BE değerlendirmeleri yapılır.
TİTCK tarafından ruhsatlandırılan ürünlerin listesi en az ayda bir kez olmak üzere TİTCK resmî internet sayfasında ve yılda bir kez olmak üzere Resmî Gazete ’de ilan edilir.
Şekil 1: Türkiye’de İlaç Ruhsatlandırma Süreci